Імунологічні підходи до терапії постковідного синдрому

Після двох років пандемії на COVID-19 — важкого гострого респіраторного синдрому, викликаного новим коронавірусом (SARS-CoV-2), більшість зусиль медичної світової спільноти спрямована на контроль росту захворюваності та лікування гострої форми цього захворювання. Однак у багатьох реконвалесцентів виникають довготривалі розлади здоров’я, які отримали назву Постковідний синдром і ці пацієнти часто лишаються без належної медичної допомоги [1–4].
Прояви Постковідного синдрому можуть спостерігатися довгий час, що не дає людям повернутися до вихідного стану здоров’я та відновити свою соціально-економічну активність, повернутися до роботи та можливості повноцінно жити і виконувати соціальну роль [2,5–7]. Більш того, у цих пацієнтів розвивається хронічний постінфекційний запальний синдром на тлі порушень імунного стану, що може призвести і до більш тяжких порушень у подальшому. Ці симптоми та розлади психосоматичного стану ґрунтуються на імунних механізмах неконтрольованого та незавершеного запалення, у деяких випадках з аутоімунними проявами [1, 8–14]. Тому важливим є вивчення патогенетичних та імунологічних механізмів розвитку Постковідного синдрому та пошук терапевтичних стратегій для відновлення здоров’я хворих.
Матеріали та методи. У межах фундаментальної НДР 159/2021 «Вивчити імунні та генетичні кореляти антиінфекційного захисту людини» на базі ДУ «Інститут мікробіології та імунології ім. І.І. Мечникова Національної академії медичних наук України» нами було обстежено 72 хворих з Постковідним синдромом. Було сформовано 4 групи пацієнтів по 18 осіб згідно з перебігом COVID-19 та терапією: перша група — легкий та друга група — тяжкий і середньо-тяжкий перебіг гострого епізоду захворювання; пацієнти, які отримували Ербісолотерапію, та контрольні групи. Групи формувалися однорідно за віком і статтю для виключення додаткової похибки: вік пацієнтів 18–60 років; середній 35,4 років; чоловіки/жінки 50 %.
Пацієнти були обстежені клінічно та лабораторно. Обстеження включало огляд і збір анамнезу та лабораторні дослідження: розширене імунологічне дослідження клітинної та гумаральної ланок, інтерлейкін-6 (IL-6), інтерлейкін-10 (IL-10), фактор некрозу пухлини-α (ФНП-α), білірубін загальний, прямий та непрямий білірубін, АЛТ, АСТ, С-реактивний білок.
Клінічні та біохімічні дослідження проводились за стандартними методиками. Клітинна ланка імунного статусу вивчалась методом проточної цитометрії, загальні імуноглобуліни та IL-6, IL-10, ФНП-α методом імуноферментного аналізу (ІФА), біохімічні дослідження проводились за стандартними методиками. Обстеження проводилось на момент звернення пацієнта та після лікування на 30 день.
Статистична обробка матеріалу проводилася за допомогою стандартної програми офісу Excel в системі Windows, з використанням автоматизованої системи Statistica. Вона включала опис вибірки, знаходження середньої арифметичної, середнє відхилення і помилки середньої арифметичної, визначалися частоти появи ознак, групування даних. Відмінності між параметрами порівняння вважалися статистично значущими при р≤0,05. Для вирішення завдань використані методи рангового кореляційного аналізу по Спирмену, лінійного регресійного аналізу. Достовірність відмінностей абсолютних і відносних показників оцінювалася з використанням критеріїв Манна-Уїтні, Крускалла-Уоллеса, «Т» і «Z» Стьюдента. При оцінці відмінностей якісних показників використовувався хі-квадрат Пірсона.

Результати та обговорення
У дослідження були взяті пацієнти, що одужали від COVID-19 14 до 60 днів потому. Пацієнти були згруповані за тяжкістю захворювання на дві когорти по 36 осіб, кожна з цих когорт була поділена на дві частини з дотриманням принципу однорідності за віком та статтю на тих, хто отримував імунореабілітуючу терапію, та контрольну групу.
У всіх обстежених було виявлено клінічні ознаки Постковідного синдрому: CХВ/ME, довготривалий субфібрилітет, артралгії. Було розроблено оригінальну шкалу скарг при Постковідному синдромі, базуючись на принципах 10-ти бальної шкали FAS (Fatigue Assessment Scale), яка оцінює симптоми втоми і була розроблена Michielsen та ін. [15]. Бали за кожною скаргою можуть варіюватися від 0, що вказує на найнижчий рівень симптому, до 10, що позначає найвищий.
За рівнем інтенсивності та частоти симптомів у пацієнтів з Постковідним синдромом прийнято: 0 («ніколи») — відсутність прояву; зростання балів відбувається зі збільшенням частоти та інтенсивності проявів — 10 балів «завжди» та потребує негайної й постійної медикаментозної терапії (Табл. 3).
Патогенетичний механізм Постковідного синдрому — це імунна дисфункція, у результаті якої виникають застряглі запальні процеси, гіперактивація хемокінового та цитокінового шляхів імунної відповіді, ініціалізація та/або активація аутоімунних процесів [8, 9, 15–19].
Постковідний синдром вражає пацієнтів з будь-яким типом перебігу гострого COVID-19 [20–25]. При лікуванні постінфекційних станів, СХВ/МЕ і Постковідного синдрому у тому числі варто визначати оптимальний перелік клініко-лабораторних обстежень для пацієнта [26–30].
При Постковідному синдромі можна рекомендувати консультації імунолога, невролога та інших вузьких спеціалістів при необхідності та лабораторні обстеження з обов’язковим включенням імунограмми [31–39]. У результаті такого комплексного підходу можливо раціонально і обґрунтовано підібрати тактику імунореабілітації [40–45].
В своєму дослідженні, виходячи зі змін у стані пацієнтів з Постковідним синдромом було застосовано комплекс імунобіологічних коректорів, широко відомих і маючих відповідний рівень безпечності та ефективності, які довго використовуються в комплексному лікуванні імунологічних розладів, аутоімунних процесів та лікуванні інших вірусних інфекцій — препаратів групи Ербісол [46–50].
Для лікування Постковідного синдрому та корекції імунодефіциту, що викликає патологічні прояви після перенесеного гострого захворювання на COVID-19, доцільно застосовувати комплекс молекулярних імунокоректорів групи Ербісол, що представляє собою цикл повного відновлення та імунореабілітації — Ербісолотерапію, яка складається з препаратів:
- Ербісол®
- Ербісол® Екстра / Ультрафарм
- та препарат «Крила Надії»
Схема та термін лікування визначається індивідуально лікарем-імунологом на основі клініко-лабораторних даних.
Нами було використано дві схеми лікування: базова для групи з тяжким та середньотяжким перебігом і зменшена для пацієнтів з легким пребігом (Табл. 1 та 2).

Обґрунтований підхід на основі патогенезу розладів у стані кожного пацієнта є запорукою успіху терапії, базуючись на параметри оптимізації та індивідуалізації лікування [47–51]. Важливим у підборі комплексу Ербісолотерапії є особливості клінічного, біохімічного та імунологічного стану пацієнтів. У даному лікувальному курсі препарати ряду Ербісол були поєднані як комплексне застосування циклу імунокоректорів, що доповнює один одне, створюючи єдину систему імунотерапії та імунореабілітації [46–53].
Фармакологічна активність препаратів визначається вмістом у них біологічно активних пептидів, яким властиві імуномодулюючі, репаративні, антиоксидантні й антигіпоксичні ефекти. Препарати класу Ербісол® активують природні, еволюційно сформовані контролюючi системи організму, що відповідають за пошук та усунення патологічних змін [42–49].
Ербісолотерапія (як базова, так і зменшена схеми) включають етапи підготовки та введення пацієнта до лікувального курсу, ініціюючого та закріплюючого курсів імунореабілітції з поступовим виведенням пацієнта із лікувальної схеми для оптимальної адаптації захисних сил організму та їх коректної та поступової реабілітації [49, 52].
Ці схеми відновлюючої терапії препаратами класу Ербісол рекомендовані для пацієнтів після інфекційних захворювань з проявами застряглого запального процесу з метою завершення запалення та імунореабілітації у залежності від тяжкості перенесеного захворювання.
Згідно з рекомендаціями виробника ін’єкції препаратів робили на голодний шлунок, (за 1–2 год. до їжі або через 2–3 год. після їжі; чай, соки, воду, тощо можна було вживати). Капсули рекомендовано приймати з водою на голодний шлунок, за 30–40 хв. перед ін’єкцією. Через 20–30 хв. після прийому капсул рекомендовано прийняти додатково пів-стакану води та через 10 хв. зробити ін’єкцію. Ввечері капсули призначалися через 3 год. після вечері [48, 51, 53].
Усі обстежені пацієнти відмічали прояви синдрому хронічної втоми/міалгічного енцефаломієліту (СХВ/МЕ), що включали слабкість, когнітивні порушення, головний біль, дифузну міалгію, депресивні симптоми та порушення сну, а також довготривалий субфібрилітет, задишку, артралгії (Табл. 3).
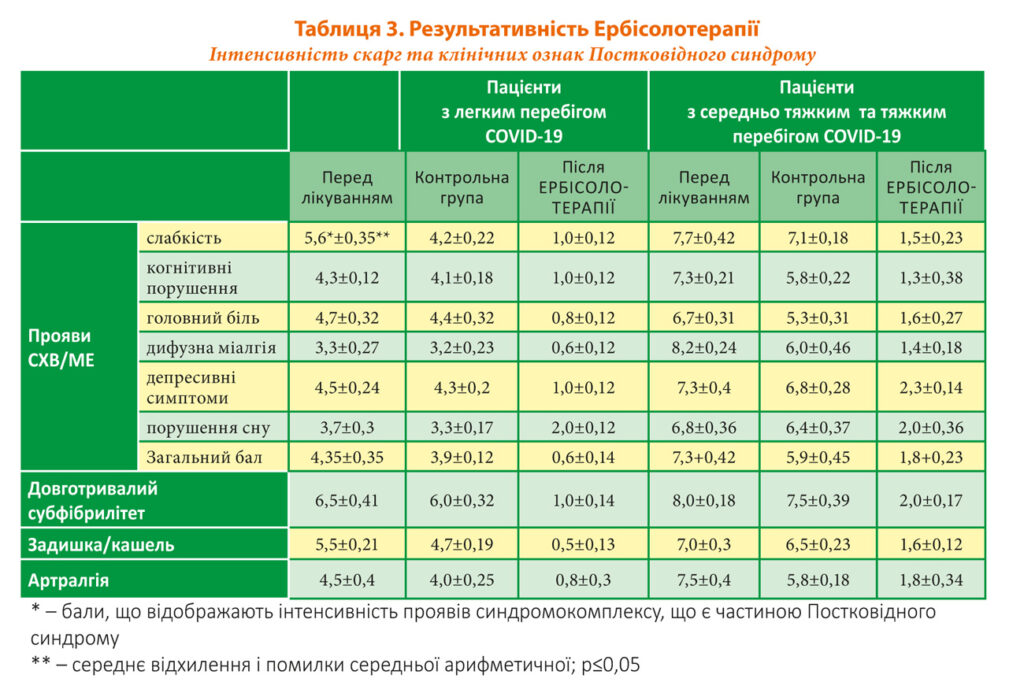
У пацієнтів, що перехворіли на COVID-19 з тяжким та середньо-тяжким перебігом, ступінь проявів СХВ/МЕ за загальним балом на початку дослідження був вищім — 7,3+0,45; 4,35+0,35 — у групи з легким перебігом на початок дослідження (Табл. 3).
Субфібрилітет, що тривав більш ніж 2 тижні, відмічали всі пацієнти, що приймали участь у дослідженні. При формуванні умовної шкали за цією ознакою бралися до уваги рівень температури тіла та постійність цього симптому. У переважної більшості обстежених температура коливалась від 37 ̊С до 37,6 ̊С, відмічалась від 3–6-х до 24-х годин протягом доби. У третини (24) пацієнтів інколи температура сягала 37,5–37,8 ̊С, 21 із них було з групи з тяжким та середньо-тяжким перебігом і 3 із групи з легким перебігом. З тяжким та середньо-тяжким перебігом — 8,0+0,18 і 6,5+0,41 з легким перебігом на початок дослідження. За скаргою на кашель та/або задишку показники становили: з тяжким та середньо-тяжким перебігом 7,0+0,3; з легким 5,5+0,21. Артралгія невеликої інтенсивності непостійна була характерна для групи з легким перебігом на рівні 3,4+0,25 та більш виражена для групи з тяжким та середньо-тяжким перебігом 7,6+0,38 (Табл. 3).
По закінченні дослідження (на 30 день) у пацієнтів з групи контролю, які не отримували імунокоригуючу терапію, не відмічалося значних змін у стані та скаргах: за симптомами СХВ/МЕ показники зменшились на 0,435 балів (10,5 %) у пацієнтів з легким перебігом і на 1,4 (18 %) з тяжким та середньо-тяжким; субфібрилітет — на 0,5 (7,7 %); 0,5 (6 %); задишка/кашель — 0,8 (14,5 %), 0,5 (7 %); артралгія 0,5 (9,5 %) і 1,7 (15 %) відповідно до груп за тяжкістю перебігу (Табл. 3).
У пацієнтів, що отримували Ербісолотерапію відзначалися значно кращі результати: симптоми СХВ/МЕ зменшились на 85,6 % (на 3,75 бали) у пацієнтів з легким перебігом, на 75 % (5,5) з тяжким та середньо-тяжким; субфібрилітет — 83,5 % (5,5); 75 % (8) відповідно; задишка/кашель — 82 % (4,5), 77,8 % (5,4); артралгія 82 % (3,7); 76 % (5,7) відповідно до груп за тяжкістю перебігу (Табл. 3).

При гострому COVID-19 відмічається лейкопенія та відносний лімфоцитоз на початку захворювання. У пацієнтів, що хворіли на COVID-19 легко, ці показники лишалися і після мікробіологічного одужання (після негативних ПЛР/антигенних тестів) відповідно до означеного нами часу — від 14 до 60 днів. У всіх пацієнтів, що мали прояви Постковідного синдрому та були відібрані до дослідження, відмічалися подібні порушення лейкоцитарної формули (Табл. 4). Цей дисбаланс імунних клітин потрібно розглядати як один із перших показників імунологічного порушення, який, вірогідно, є одним з тригерів розвитку Постковідного синдрому.
У пацієнтів, які перенесли COVID-19 у тяжкій та середньо-тяжкій формі, розвивається «цитокінова буря» і, як наслідок функціональних порушень, у подальшому бактеріальне запалення. Механізм імунно-опосередкованого пошкодження може бути зумовлений як надмірною активацією імунної системи з гіперпродукцією інтерлейкіну-4 (IL-4), інтерлейкіну-6 (IL-6) і фактору некрозу пухлини-α (TNF-α), так і генеруванням аутоімунної реакції, яка, вірогідно, лежить у основі СХВ/МЕ, синдрому Гієна-Барре та реактивних артритів [18, 20, 39–41]. У більшості таких пацієнтів при одужанні спостерігається лейкоцитоз та нейтрофільоз. Однак ці зміни та перенесене гостре запалення також лишають по собі розлади у імунному статусі та запускають механізми розвитку Постковідного синдрому (Табл. 4).
Чітке розуміння механізмів застряглого запалення та імунних й аутоімунних змін після COVID-19 потребує подальших досліджень. Однак, ґрунтуючись на виявлених змінах у імунних та біохімічних показниках, необхідно зважено сформувати напрями реабілітації та терапії таких хворих.
При дослідженні було виявлено, що у всіх обстежених пацієнтів є імунологічні зміни. У групі з легким перебігом показники T helpers (CD3+4+), імунорегуляторного індексу (CD4/CD8), NK Т (CD3+CD16+56+) були знижені, і навпаки підвищені у групі середньо-тяжкого перебігу. У всіх пацієнтів була тенденція до підвищення B Cells (CD19+), NK (CD3-CD16+56+), гетерофільних гемолізинів, лімфоцитотоксичних аутоАТ, загальних Ig G та Ig М, знижених показниках комплементу (СН50), при умовному зниженню T cells (CD3+) mean – показники наближались до нижньої границі норми (Табл.4). Показовим була наявність значних імунологічних змін, хоча і у деяких аспектах діаметрально відмінних, і у людей, що хворіли на COVID-19 легко, і у тих хто хворів з середньо-тяжким перебігом (Табл.4).
У групах контролю, які не отримували імунокоригуючої терапії, на кінець дослідження показники імунного статусу не мали достовірних відмінностей від показників на початку (зміни коливались у межах 5 %).
Імунологічні показники після курсу Ербісолотерапії нормалізувалися:
- були відсутні ознаки порушення відхилень у лейкоцитарній формулі;
- стабілізувалися показники клітинної ланки: B Cells (CD19+), імунорегуляторного індексу (CD4/CD8), NK (CD3-CD16+56+), гетерофільних гемолізинів, лімфоцитотоксичних аутоАТ;
- піднялись до нормальних рівнів показники T cells (CD3+) mean, T activated (CD3+HLADr+), NK T (CD3+CD16+56+) (Табл. 2). Порушення гуморальної ланки імунної системи після курсу лікування були відсутні в усіх групах (Табл. 4).
Показники цитокінового профілю навіть після означеного часу від 14 до 60 днів з моменту одужання виявляли ознаки запалення та цитокінового дисбалансу. Значення у пацієнтів з легким перебігом також були збільшені, однак менше, ніж у іншої групи, де показники практично вдвічі перевищували норму. Після дослідження у групах, які не отримували специфічної імунокоригуючої терапії, показники цитокінового профілю поступово зменшувались, але не досягали норми, а групи, які отримували Ербісолотерапію, означили стабільну позитивну динаміку з впевненою нормалізацією значень інтерлейкінів та ФНП наприкінці дослідження.
У всіх пацієнтів були виявлені ознаки ураження печінки: збільшення білірубіну загального, прямого та непрямого, АЛТ, АСТ. У результаті лікування за схемами Ербісолотерапії показники біохімії печінки нормалізувались у 95 % пацієнтів з обох груп дослідження, а у пацієнтів з контрольної групи показники прийшли у межі норми лише у 45,5 % випадків за період спостереження (Табл. 4). С-реактивний білок стабільно нормалізувався у 97 % обстежених уже на 2-му тижні лікування, у групі контролю він лишався підвищеним на 15–50 % навіть на кінець обстеження, що відповідає рівню інтенсивності скарг у пацієнтів в цілому та зокрема по артралгіям.
У групах пацієнтів з Постковідним синдромом, яким була призначена Ербісолотерапія, відмічалася повна нормалізація біомаркерів запалення та біохімії печінки. У пацієнтів з контрольної групи з часом за період дослідження показники приближувалися до норми, однак лишалися або на межі або злегка підвищеними, що є наслідком токсикації та невщухлого запалення.

ЕРБІСОЛ® виявляє ефективність при лікуванні гострих і хронічних гепатитів різної етіології, включаючи токсичнi, медикаментознi та вiруснi гепатити, при яких препарат активізує процеси регенерації печінки. При вірусних гепатитах ЕРБІСОЛ®, крiм того, активізує цитотоксичні Т-лімфоцити (CD8+) та Т-кілери (CD3+16+56+), відповідальні за знищення клітин-вірусоносіїв, а також індукує синтез α-, β- і γ-інтерферону, підвищує їх рівень у крові в 4–6 разів, що сприяє прискоренню елімінації вірусу. У той же час, активізуючи процеси регенерації печінки, препарат сприяє заміщенню загиблих гепатоцитів здоровими клітинами, що дозволяє віднести ЕРБІСОЛ® до препаратів, які полегшують перебіг тяжкості інфекційного захворювання. Препарат виявляє протизапальні властивості. ЕРБІСОЛ® сприяє нормалізації функцій гепатоцитів, виявляє виражений антиоксидантний і мембраностабілізуючий ефекти на рівні плазматичних мембран, запобігає розвитку дистрофії, цитолізу та холестазу, а також атеросклерозу при ураженнях печінки, сприяє нормалізації рівня білірубінів і трансаміназ. Це призводить до швидкого зникнення астеновегетативного, диспептичного та больового синдромів. Активуючи функції печінки, препарат сприяє прискоренню видалення з органiзму сторонніх токсичних агентів та шкідливих продуктів його життєдіяльності.
Пацієнтам після курсу лікування було рекомендовано дотримуватися здорового способу життя та повторне імунологічне обстеження через 3 місяці з можливістю додаткового імунокоригуючого курсу Ербісолотерапії при повторній появі відхилень або скарг.
Висновки
Визначення причин та механізмів розвитку Постковідного запалення потребує подальших досліджень, однак вже сьогодні ми можемо обґрунтовано, зважено та ефективно допомагати пацієнтам з проявами цього синдрому, маючи можливість індивідуалізувати та підібрати відповідну схему у кожному окремому випадку. Важливим у стратегіях медичної допомоги людям з Постковідним синдромом є залучення до консультацій у першу чергу імунологів, а також необхідних за спектром проявів вузьких спеціалістів.
Група лікарських засобів Ербісол дозволяє вирішити декілька важливих задач, що постають перед лікарем у випадку Постковідного стану:
- підібрати схему лікування в залежності від змін у імунному статусі, так як кожний із препаратів має певний напрям дії;
- ефективно відновити та стабілізувати імунну систему пацієнта;
- запустити природжені системи репарації органів та тканин;
- і в результаті вищезазначеного, допомогти пацієнту повернути здоров’я та звичний ритм життя.
Список літератури:
- Bulut C., Kato Y. Epidemiology of COVID-19. Turk J Med Sci. 2020;50(SI-1):563–570. doi: 10.3906/sag-2004-172. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Greenhalgh T, Knight M, A’Court C, et al.. Management of post-acute covid-19 in primary care. BMJ 2020; 370: m3026. [PubMed] [Google Scholar]
- Garner P. Covid-19 at 14 weeks—phantom speed cameras, unknown limits, and harsh penalties. BMJ Opinion, https://blogs.bmj.com/bmj/2020/06/23/paul-garner-covid-19-at-14-weeks-phantom-speed-cameras-unknown-limits-and-harsh-penalties/2020. (2020, accessed 25 October 2020).
- Ladds E, Rushforth A, Wieringa S, et al. Persistent symptoms after COVID-19: qualitative study of 114 “long COVID” patients and draft quality criteria for services. J Infect Dis. Epub ahead of print 14 October 2020. DOI: 10.1101/2020.10.13.20211854. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Michelen M, Manoharan L, Elkheir N, et al. Characterising long-term covid-19: a rapid living systematic review. Glob Public Health. Epub ahead of print 9 December 2020. DOI: 10.1101/2020.12.08.20246025. [CrossRef] [Google Scholar]
- Lim EJ, Ahn YC, Jang ES, et al. Systematic review and meta-analysis of the prevalence of Chronic Fatigue Syndrome/Myalgic Encephalomyelitis (CFS/ME). J Transl Med 2020; 18: 100. [PMC free article] [PubMed] [Google Scholar]
- Petter Brodin. Immune determinants of COVID-19 disease presentation and severity. Nat Med. 2021 Jan;27(1):28-33. doi: 10.1038/s41591-020-01202-8. Epub 2021 Jan 13.
- Cabler SS, French AR, Orvedahl A. A Cytokine Circus with a Viral Ringleader: SARS-CoV-2-Associated Cytokine Storm Syndromes. Trends Mol Med. 2020 Dec;26(12):1078-1085. doi: 10.1016/j.molmed.2020.09.012. Epub 2020 Sep 30. PMID: 33051104 Free PMC article. Review.
- Weidinger C, Hegazy AN, Glauben R, Siegmund B. COVID-19-from mucosal immunology to IBD patients. Mucosal Immunol. 2021 May;14(3):566-573. doi: 10.1038/s41385-021-00384-9. Epub 2021 Feb 19. PMID: 33608656 Free PMC article. Review.
- Kempuraj D., Selvakumar G.P., Ahmed M.E. COVID-19, mast cells, cytokine storm, psychological stress, and neuroinflammation. Neuroscientist. 2020 doi: 10.1177/1073858420941476. [published online ahead of print, 18 July 2020] [PubMed] [CrossRef] [Google Scholar]
- Divij Mathew, Josephine R. Giles, Amy E. Baxter, et al. Deep immune profiling of COVID-19 patients reveals patient heterogeneity and distinct immunotypes with implications for therapeutic interventions. bioRxiv. 2020 May 23. doi: 10.1101/2020.05.20.106401
- Shi Y., Wang Y., Shao C., et al. COVID-19 infection: the perspectives on immune responses. Cell Death Differ. 27, 1451–1454 (2020). [PMC free article] [PubMed] [Google Scholar]
- Vabret N., Britton G. J., Gruber C., et al. Immunology of COVID-19: current state of the science. Immunity (2020), doi:10.1016/j.immuni.2020.05.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Weiskopf D., Schmitz K. S., Raadsen M. P., et al. Others, Phenotype of SARS-CoV-2-specific T-cells in COVID-19 patients with acute respiratory distress syndrome. medRxiv (2020) https://www.medrxiv.org/content/10.1101/2020.04.11.20062349v1.abstract. [Google Scholar]
- Michielsen HJ, De Vries J, Van Heck GL Psychometric qualities of a brief self‐rated fatigue measure the fatigue assessment scale. J Psychosom Res. 2003;54(4):345–52. [PubMed] [Google Scholar]
- Giamarellos-Bourboulis EJ, Netea MG, Rovina N, et al. Complex Immune Dysregulation in COVID-19 Patients with Severe Respiratory Failure. Cell Host Microbe. 2020 Jun 10;27(6):992-1000.e3. doi: 10.1016/j.chom.2020.04.009. Epub 2020 Apr 21. PMID: 32320677
- Luo W., Li Y.X., Jiang L.J., Chen Q., Wang T., Ye D.W. Targeting JAK-STAT signaling to control cytokine release syndrome in COVID-19. Trends Pharmacol Sci. 2020;41(8):531–543. doi: 10.1016/j.tips.2020.06.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mangalmurti N., Hunter C.A. Cytokine storms: understanding COVID-19. Immunity. 2020 doi: 10.1016/j.immunol.2020.06.017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mehta P., McAuley D.F., Brown M. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033–1034. doi: 10.1016/S0140-6736(20)30628-0.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meyer L., Verbist K.C., Albeituni S. JAK/STAT pathway inhibition sensitizes CD8 T cells to dexamethasone-induced apoptosis in hyperinflammation. Blood. 2020 doi: 10.1182/blood.2020006075. [published online ahead of print, 12 June 2020] [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Lawrence B Afrin, Leonard B Weinstock, Gerhard J Molderings. Covid-19 hyperinflammation and post-Covid-19 illness may be rooted in mast cell activation syndrome. Int J Infect Dis. 2020 Nov;100:327-332. doi: 10.1016/j.ijid.2020.09.016. Epub 2020 Sep 10.
- Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(5):846–848. doi: 10.1007/s00134-020-05991-x. [Supplemented by: Ruan Q., Yang K., Wang W., Jiang L., Song J. Correction to: Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(6):1294–1297. DOI: 10.1007/s00134-020-06028-z.] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Afrin L.B., Pöhlau D., Raithel M. Mast cell activation disease: an underappreciated cause of neurologic and psychiatric symptoms and diseases. Brain Behav Immun. 2015;50:314–321. doi: 10.1016/j.bbi.2015.07.002. [PubMed] [CrossRef] [Google Scholar]
- Criado P.R., Pagliari C., Criado R.F.J., Marques G.F., Belda W., Jr. What the physicians should know about mast cells, dendritic cells, urticaria, and omalizumab during COVID-19 or asymptomatic infections due to SARS-CoV-2? Dermatol Ther. 2020 doi: 10.1111/dth.14068. [published online ahead of print, 25 July 2020] [PubMed] [CrossRef] [Google Scholar]
- Afrin L.B., Butterfield J.H., Raithel M., Molderings G.J. Often seen, rarely recognized: mast cell activation disease–a guide to diagnosis and therapeutic options. Ann Med. 2016;48(3):190–201. doi: 10.3109/07853890.2016.1161231. [PubMed] [CrossRef] [Google Scholar]
- Abraham S.N., St John A.L. Mast cell-orchestrated immunity to pathogens. Nat Rev Immunol. 2010;10:440–452. [PMC free article] [PubMed] [Google Scholar]
- Afrin L.B., Ackerley M.B., Bluestein L.S. Diagnosis of mast cell activation syndrome: a global “consensus-2” Diagnosis (Berl) 2020 doi: 10.1515/dx-2020-0005. /j/dx.ahead-of-print/dx-2020-0005/dx-2020-0005.xml [published online ahead of print, 22 April 2020] [PubMed] [CrossRef] [Google Scholar]
- Haenisch B., Fröhlich H., Herms S., Molderings G.J. Evidence for contribution of epigenetic mechanisms in the pathogenesis of systemic mast cell activation disease. Immunogenetics. 2014;66(5):287–297. doi: 10.1007/s00251-014-0768-3. [PubMed] [CrossRef] [Google Scholar]
- Abu-Rumeileh S, Abdelhak A, Foschi M, Tumani H, Otto M. Guillain-Barré syndrome spectrum associated with COVID-19: an up-to-date systematic review of 73 cases. J Neurol. 2021 Apr;268(4):1133-1170. doi: 10.1007/s00415-020-10124-x. Epub 2020 Aug 25. PMID: 32840686 Free PMC article.
- Uncini A, Vallat JM, Jacobs BC. Guillain-Barré syndrome in SARS-CoV-2 infection: an instant systematic review of the first six months of pandemic. J Neurol Neurosurg Psychiatry. 2020 Oct;91(10):1105-1110. doi: 10.1136/jnnp-2020-324491. Epub 2020 Aug 27. PMID: 32855289
- Pelea T, Reuter U, Schmidt C, Laubinger R, Siegmund R, Walther BW. SARS-CoV-2 associated Guillain-Barré syndrome. J Neurol. 2021 Apr;268(4):1191-1194. doi: 10.1007/s00415-020-10133-w. Epub 2020 Aug 8. PMID: 32770414 Free PMC article.
- Agosti E, Giorgianni A, D’Amore F, Vinacci G, Balbi S, Locatelli D. Is Guillain-Barrè syndrome triggered by SARS-CoV-2? Case report and literature review. Neurol Sci. 2021 Feb;42(2):607-612. doi: 10.1007/s10072-020-04553-9. Epub 2020 Jul 9. PMID: 32643136 Free PMC article. Review.
- Sansone P, Giaccari LG, Aurilio C, et al. Post-Infectious Guillain-Barré Syndrome Related to SARS-CoV-2 Infection: A Systematic Review. Life (Basel). 2021 Feb 21;11(2):167. doi: 10.3390/life11020167. PMID: 33670000 Free PMC article. Review.
- Daniel Wendling, Frank Verhoeven, Mickael Chouk, Clément Pratia. Can SARS-CoV-2 trigger reactive arthritis? Joint Bone Spine. 2021 Jan; 88(1): 105086. Published online 2020 Oct 27. doi: 10.1016/j.jbspin.2020.105086 PMCID: PMC7590820
- Richez C., Flipo R.M., Berenbaum F. Managing patients with rheumatic diseases during the COVID-19 pandemic: the French Society of Rheumatology answers to most frequently asked questions up to May 2020. Joint Bone Spine. 2020 doi: 10.1016/j.jbspin.2020.05.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mikuls T.R., Johnson S.R., Fraenkel L. American College of Rheumatology Guidance for the management of rheumatic disease in adult patients during the COVID-19 pandemic: version 2. Arthritis Rheumatol. 2020 doi: 10.1002/art.41437. [Online ahead of print] [PubMed] [CrossRef] [Google Scholar]
- Felten R., Chatelus E., Arnaud L. How and why are rheumatologists relevant to COVID-19? Joint Bone Spine. 2020;87:279–280. [PMC free article] [PubMed] [Google Scholar]
- Liew J.W., Castillo M., Zaccagnino E. Patient-reported disease activity in an axial spondyloarthritis cohort during the COVID-19 pandemic. ACR Open Rheumatol. 2020 doi: 10.1002/acr2.11174. [Online ahead of print] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Quartuccio L., Valent F., Pasut E. Prevalence of COVID-19 among patients with chronic inflammatory rheumatic diseases treated with biologic agents or small molecules: a population-based study in the first two months of COVID-19 outbreak in Italy. Joint Bone Spine. 2020 doi: 10.1016/j.jbspin.2020.05.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Joob B., Wiwanitkit V. Arthralgia as an initial presentation of COVID-19: observation. Rheumatol Int. 2020;40:823. [PMC free article] [PubMed] [Google Scholar]
- López-González M.D., Peral-Garrido M.L., Calabuig I. Case series of acute arthritis during COVID-19 admission. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-217914. [PubMed] [CrossRef] [Google Scholar]
- Saricaoglu E.M., Hasanoglu I., Guner R. The first reactive arthritis case associated with COVID-19. J Med Virol. 2020 doi: 10.1002/jmv.26296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Liew I.Y., Mak T.M., Cui L. A case of reactive arthritis secondary to coronavirus disease 2019 infection. J Clin Rheumatol. 2020;26:233. [PMC free article] [PubMed] [Google Scholar]
- Ono K., Kishimoto M., Shimasaki T. Reactive arthritis after COVID-19 infection. RMD Open. 2020;6:e001350. [PMC free article] [PubMed] [Google Scholar]
- Yokogawa N., Minematsu N., Katano H. Case of acute arthritis following SARS-CoV-2 infection. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218281. [PubMed] [CrossRef] [Google Scholar]
- Alivernini S., Cingolani A., Gessi M. Comparative analysis of synovial inflammation after SARS-CoV-2 infection. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218315. [Online ahead of print] [PubMed] [CrossRef] [Google Scholar]
- Фесенкова В. Й., Драннік Г. М., Дріянська В. Є., [et al.]. ДОСЛІДЖЕННЯ IN VITRO ВПЛИВУ ПРЕПАРАТІВ ЕРБІСОЛ НА ПРОДУКЦІЮ ІНТЕРЛЕЙКІНУ-2 ТА γ-ІНТЕРФЕРОНУ Т-ХЕЛПЕРАМИ І ТИПУ ЗДОРОВИХ ДОНОРІВ. Лабораторна діагностика. — 2003. — № 2. — С. 37-40
- Гиріна О. М., Вітик Л. Д., Романюк Л. І., [et al.]. ОПТИМІЗАЦІЯ ЛІКУВАННЯ ХВОРИХ НА ПОЛІНОЗ ШЛЯХОМ ЗАСТОСУВАННЯ ПРЕПАРАТУ ЕКСТРА ЕРБІСОЛ. Збірник наукових праць співробітників НМАПО ім. П.Л.Шупика. — Київ. — 2006. — Вип. 15, кн. 2. — С. 206-211
- Корнилина Е. М., Николаенко А. Н., Вовк А.Д., [et al.]. ХАРАКТЕРИСТИКА ФЕНОТИПА ЛЕЙКОЦИТОВ КРОВИ БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С В ДИНАМИКЕ ЛЕЧЕНИЯ ПРЕПАРАТОМ ЭРБИСОЛ® УЛЬТРАФАРМ. Імунологія та алергологія. — 2006. — № 4. — С. 69-71
- Дранник Г. Н., Курченко А. И., Фесенкова В. Й., [et al.]. ИЗУЧЕНИЕ ВЛИЯНИЯ ПРЕПАРАТОВ КЛАССА ЭРБИСОЛ® НА ПРОДУКЦИЮ ЦИТОКИНОВ МОНОНУКЛЕАРАМИ ПЕРИФЕРИЧЕСКОЙ КРОВИ ЗДОРОВЫХ ДОНОРОВ И ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ. Вісник фармакології та фармації. — 2006. — № 7. — С. 29-32
- Базыка Д., Гладкий А., Корнилина Е., Николаенко А. ОСОБЕННОСТИ ВЛИЯНИЯ ПРЕПАРАТОВ КЛАССА ЭРБИСОЛ НА ЭКСПРЕССИЮ ПОВЕРХНОСТНЫХ МАРКЕРОВ КЛЕТОК КРОВИ ЗДОРОВЫХ ДОНОРОВ И БОЛЬНЫХ С ИММУНОДЕПРЕССИЕЙ КЛЕТОЧНОГО ИММУНИТЕТА IN VITRO И В ДИНАМИКЕ ЛЕЧЕНИЯ. Вісник фармакології та фармації. — 2009. — № 1. — С. 39-47
- Лазарев К.Л., Сатаева Т.П. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ИММУНОМОДУЛЯТОРОВ ЭМБРИОНАЛЬНОГО ПРОИСХОЖДЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕНОМЕНА ЭПИТЕЛИАЛЬНО- МЕЗЕНХИМАЛЬНОЙ ТРАНСФОРМАЦИИ. Крымский журнал экспериментальной и клинической медицины. — 2012. — Т. 2, № 1-2 (5-6). — С. 83-85
- Неміровська Н В. ДИНАМІКА ЗМІН ІМУНОЛОГІЧНОГО СТАТУСУ ТА ЛІПІДНОГО ОБМІНУ У ХВОРИХ НА ПОЛІНОЗ З ХОЛЕСТЕРОЗОМ ЖОВЧНОГО МІХУРА НА ФОНІ ЛІКУВАННЯ. Астма та алергія. — 2013. — № 1. — С. 50-54
Давидова Т.В., канд. мед. наук, імунолог, старший науковий співробітник лабораторії імунореабілітології ДУ «Інститут мікробіології та імунології ім. І.І. Мечникова Національної академії медичних наук України»

 21-ноб-2024
21-ноб-2024
