АФФИДА-ФОРТ-німесулід® —надійний союзник у боротьбі з гострим болем

«Біль — це сигнал тривоги, який змушує нас звернути увагу на своє здоров’я». Гіппократ
Біль є одним із найпоширеніших та найбільш універсальних симптомів, з якими стикаються люди протягом усього життя. Він може варіювати від легкого дискомфорту до нестерпного страждання, що впливає на якість життя та здатність виконувати повсякденні обов’язки. Дійсно, життя з болем з кожним днем все сильніше і сильніше нагадує боротьбу: біль виснажує, забирає життєві сили та нерідко призводить до депресивних станів.
БІЛЬ – найтяжкий прояв 90 % усіх захворювань та патологічних станів, що визначає порушення соціальної адаптації у сотень мільйонів жителів Землі. Постійне збільшення числа осіб, які відчувають виражений та тривалий біль, є однією з найбільш серйозних, глобальних проблем, що стоять перед сучасним суспільством [1]. Насамперед, це пов’язано з широкою поширеністю хвороб суглобів та хребта, для яких скелетно-м’язовий біль є основним проявом.
НА ЗАМІТКУ!
За даними Всесвітньої організації охорони здоров’я, до 2 млрд. жителів Землі періодично або постійно відчувають біль [2].
БОЛЬОВИЙ СИНДРОМ — це системний патологічний процес, що включає місцеву реакцію на ураження, передачу та сприйняття больового імпульсу, його психоемоційну оцінку і відповідну вегетативну та поведінкову реакцію організму.
Міжнародна асоціація дослідження болю (International Association for the Study of Pain) запропонувала вважати біль багатофакторною моделлю, а саме: «неприємним відчуттям і емоційним переживанням, пов’язаним із наявним або можливим пошкодженням тканин» [3].
Виокремлюють наступні класифікації болю [4]:
І. ЗА МЕХАНІЗМОМ РОЗВИТКУ:
1) ноцицептивний: соматичний (поверхневий та глибокий) та вісцеральний;
2) невропатичний: периферичний (пошкодження або захворювання корінців периферичних нервів, сплетінь або вегетативних гангліїв) та центральний (внаслідок ураження головного або спинного мозку — таламічний біль, фантомний біль, біль при розсіяному склерозі);
3) психогенний (виникає на тлі депресії, тривоги, фобії, іпохондрії);
4) змішаний.
ІІ. ЗА ТРИВАЛІСТЮ:
1) гострий (короткотривалий з високою інтенсивністю);
2) хронічний (розвивається протягом тривалого часу — від кількох місяців до багатьох років — монотонний, виснажливий, часто охоплює великі ділянки тіла);
3) рецидивуючий.
ІІІ. ЗА ЕТІОЛОГІЄЮ (ПРИЧИНОЮ ВИНИКНЕННЯ):
1) фізіологічний — виникає як відповідь на дію шкідливого (патогенного) чинника;
2) патологічний — розвивається при ураженні нервової системи;
3) ідіопатичний (не встановлено генезу).
ЗА АНАТОМІЧНОЮ ЛОКАЛІЗАЦІЄЮ:
1) місцевий;
2) проекційний.
ЦЕ ЦІКАВО!
- Вчені підрахували, що щодня кожна людина відчуває більше ста больових нападів, однак свідомість фіксує далеко не всі з них. В нашому мозку є, так званий, «центр болю», який контролює больові імпульси і «відкидає» найслабші. Ця ділянка має назву інсула і знаходиться вона глибоко між півкулями мозку. Іноді «центр болю» дає збій, і тоді людина може весь час відчувати безсимптомний біль. Різновид даної проблеми називається фіброміалгією, або «летючими болями».
- На земній кулі проживає приблизно 500 людей, які ніколи не відчувають болю. Відсутність болю — це рідкісна хвороба — сирінгомієлія. Ця хвороба є спадковою або може виникнути внаслідок тяжкої мозкової травми. При цьому у людини відсутня чутливість нервових закінчень.
- Незважаючи на те, що головний мозок сприймає сигнали про біль від всіх частин нашого тіла, це єдиний орган, який не здатний відчувати його, так як зовсім позбавлений больових нервових рецепторів.
- Жінки володіють більш високим больовим порогом, ніж чоловіки. Це пов’язано з тим, що естрогени — жіночі статеві гормони, володіють природною аналгетичною дією.
- Наш організм має «больову пам’ять». Про це свідчать фантомні болі.
- Виявляється, можна відчути чужий біль. Це пов’язано з тим, що «центр болю» обробляє візуальний сигнал і проектує його на ваше тіло. Це називається феноменом співпереживання, і відчувати його можуть тільки люди.
- Є ряд продуктів, що подразнюють нервові закінчення. Наприклад, сир пармезан, оцет, копчене м’ясо, шоколад та продукти, що містять глютамат натрію (ковбаси, консерви, розчинні супи), здатні викликати напади головного болю.
ЯКИМ ЧИНОМ ВИНИКАЄ БОЛЬОВЕ ВІДЧУТТЯ?
Задля успішного ефективного лікування болю необхідно чітко розуміти механізм його розвитку як складного, багатофакторного системного процесу. Це слугує основою для створення системи раціональної та дієвої аналгетичної терапії, де кожен елемент патогенезу болю повинен розглядатися як перспективна «мішень» для фармакологічного втручання.
Одну із ключових ролей в розвитку гострого та хронічного болю відіграє запальний процес. Запалення — стадійний процес, що виникає у відповідь пошкодження; він включає системну, а також локальну гуморальну і клітинну реакції, спрямовані на усунення прозапального фактору, видалення зруйнованих в результаті пошкодження клітин та елементів міжклітинного матриксу.
Пошкодження тканини призводить до прямої стимуляції больових рецепторів — ноцицепторів — які є вільними закінченнями нервових волокон, що володіють специфічністю сприйняття фізичних і хімічних факторів (механічного тиску, підвищення температури, зміни рН позаклітинного середовища та впливу ряду хімічних речовин). Первинне подразнення ноцицепторів формує відчуття гострого болю [1, 4].
Однак якщо пошкодження є значним і супроводжується вираженою запальною реакцією, а процеси відновлення вимагають тривалого часу, «налаштування» ноцицептивної системи змінюється — у її роботу включається механізм прогресуючого зниження порогу збудливості нейронів больової системи. Розвиток сенситизації тісно пов’язаний з активним запаленням. Зміна порога збудливості ноцицепторів виникає під впливом особливих, різних за своєю хімічною природою речовин — медіаторів запалення та болю, дія яких передається нейронам після контакту з відповідними мембранними рецепторами. Існує кілька джерел медіаторів болю та запалення: ейкозаноїди — простагландин Е2 (ПГЕ2) і лейкотрієн В4, які синтезуються багатьма клітинними елементами в вогнищі пошкодження під впливом цитокінів, які, в свою чергу, здійснюють продукцію попередників ПГЕ2 та лейкотрієну В4: циклооксигенази-2 (ЦОГ-2) та 5-ліпооксигенази відповідно. Іншим джерелом медіаторів є плазма крові, що проникає в міжклітинний простір шляхом ексудації: так, ноцицептори зустрічаються з брадикініном. Отже, у процесі запальної реакції міжклітинний простір у ділянці пошкодження насичується прозапальними медіаторами, формуючи так званий запальний, або сенситизуючий, «суп» [2].
Подразнення больових рецепторів у вогнищі запалення призводить до появи низки патологічних симптомів і специфічної поведінки, а саме:
- серцево-судинна система — тахікардія, підвищення артеріального тиску, гостра ішемія міокарду;
- дихальна система — гіпоксія, запальні процеси в легенях, зменшення життєвої ємності легень;
- шлунково-кишковий тракт — парез кишечнику, транслокація кишкової флори;
- зсідання крові — гіперкоагуляція, тромбоз глибоких вен, тромбоемболія;
- центральна нервова система — формування хронічного больового синдрому.
Одним із головних напрямів знеболювання пов’язують із застосуванням препаратів, що володіють протизапальною дією — нестероїдні протизапальні препарати (НПЗП). Це виправдано роллю запального процесу в розвитку гострого та хронічного болю.
НПЗП належать до найпоширеніших лікарських засобів, які застосовуються в клінічній практиці протягом останніх 30 років. Їх надзвичайно висока популярність визначається тим, що їх неможливо замінити в терапії більшості захворювань, які супроводжуються запаленням, болем чи гарячкою.
Застосування НПЗП показано при численних захворюваннях та патологічних станах, для яких характерним є розвиток вираженого больового синдрому та запального процесу:
- гострий чи хронічний біль у м’язах та кістках (остеоартрит, ревматоїдний артрит, біль в спині, подагра тощо);
- травмах та інших станах, пов’язаних із пошкодженням чи гострим запаленням;
- болі в післяопераційний період;
- біль при нирковій та біліарній коліках;
- головний біль напруги та мігрень;
- болі, пов’язані із онкологічними станами;
- болі при дисменореї [1].
Одним з найбільш суттєвих досягнень фармакології та клінічної медицини останнього десятиліття є розробка та впровадження у клінічну практику НПЗП з селективною дією на ЦОГ-2, що забезпечує ефективність з відносно меншими побічними ефектами порівняно з традиційними НПЗП.
ЦОГ-1 VS ЦОГ-2?
ЦОГ-1 (конститутивна) є структурним ферментом, синтезується в більшості клітин здорового організму і каталізує утворення фізіологічних ПГ, тромбоксану та простацикліну. Бере участь в регуляції ряду фізіологічних процесів в організмі, таких як захист слизової оболонки ШКТ, забезпечення ниркового кровотоку, регуляція судинного тонусу, зсідання крові, кістковий метаболізм, ріст нервової тканини, вагітність, процеси регенерації та апоптозу.
ЦОГ-2 (індуцибельна) відповідає за синтез ПГ, які беруть участь в розвитку запальної реакції, та стимулює макрофаги, моноцити, синовіоцити, хондроцити, фібробласти, остеобласти, ендотеліальні клітини та
цитокіни.
ЦЕ ЦІКАВО!
НПЗП: ВІД МИНУЛОГО ДО СЬОГОДЕННЯ
- Жарознижувальні та знеболювальні властивості кори верби та мирту (джерела саліцилатів) були відомі ще в Стародавньому Єгипті та Римі. На папірусах, датованих ІІ тисячоріччям до нашої ери, описані рекомендації щодо використання листя мирти при ревматичному болю і радикуліті. Близько тисячі років потому Гіпократ у своїх настановах рекомендував використовувати кору верби у вигляді відвару при лихоманці та болю під час пологів
- У 1757 році Едмунд Стоун розпочав клінічні спостереження із застосуванням кори верби, які знайшли своє завершення у його листі від 25 квітня 1763 р. президенту Лондонського королівського товариства, де повідомлялось: «В Англії росте дерево, кора якого, як я переконався на досвіді, є сильно в’яжучим засобом і дуже ефективна для лікування лихоманки та інших захворювань, які супроводжуються періодичними нападами жару»
- Використання НПЗП бере свій початок з 1874 року, коли у Німеччині Г. Кольбе розробив технологію синтезу саліцилової кислоти
- 1876 рік у журналі «Lancet» опубліковано працю Mayers A. B. з результатами використання саліцилової кислоти для лікування хворих на гострий ревматизм, у якій були відзначені негативні впливи препарату на ШКТ. Це повідомлення можна вважати першим повідомленням про несприятливі впливи НПЗП на систему травлення.
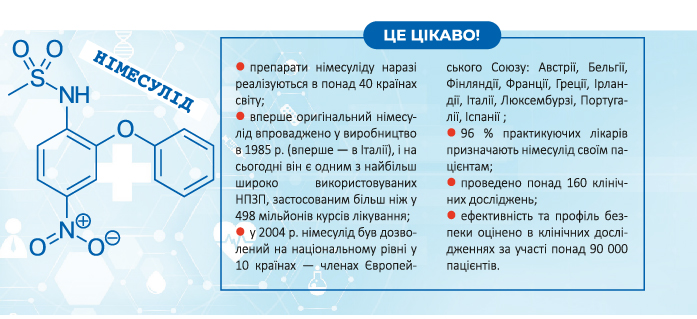
- Оригінальний німесулід було розроблено фармацевтичною компанією Helsinn Healthcare SA, яка отримала ліцензію та ексклюзивні всесвітні права на нього від компанії 3M-Riker у 1980 р. На сьогодні компанія Helsinn Healthcare SA продовжує продукцію активних інгредієнтів оригінального німесуліду та готовий препарат згідно із сучасними настановами належної виробничої практики (GMP) на базі власних заводів у Швейцарії та Ірландії.
Helsinn також виробляє активні інгредієнти оригінального німесуліду та готовий препарат згідно із сучасними настановами належної виробничої практики (GMP) на базі власних заводів у Швейцарії та Ірландії.
Німесулід — це НПЗП, який має протизапальну, аналгетичну, жарознижувальну та антиагрегантну дію та на відміну від інших нестероїдних протизапальних засобів селективно пригнічує ЦОГ-2, гальмує синтез ПГ у вогнищі запалення; має менш виражений пригнічуючий вплив на ЦОГ-1, а отже рідше спричиняє побічні ефекти, пов’язані з пригніченням синтезу ПГ у здорових тканинах (гастротоксичність, кардіотоксичніть тощо).
Відомо, що для пацієнток із легкою та середнього ступеня тяжкості дисменореєю, нормальним співвідношенням естрадіолу та прогестерону препаратами вибору є НПЗП. Саме дана група лікарських засобів є патогенетично обґрунтованим варіантом терапії у дівчаток із легкою формою первинної дисменореї, при переважанні змішаного та парасимпатичного тонусу вегетативної нервової системи. Доцільним є застосування НПЗП саме протягом перших 48-72 год після початку менструації. Це обумовлено тим фактом, що згідно ряду досліджень, ПГ виділяються в менструальну кров у максимальній кількості в перші 48 годин менструації. Найбільш ефективним із групи НПЗП є німесулід, оскільки пероральний прийом 200 мг німесуліду при наявності симптомів дисменореї в подвійному плацебо-контрольованому перехресному дослідженні сприяв зниженню рівня ПГ в менструальній крові з 382 до 94 мкг/л, а також призводив до зниження симптомів болі у пацієнток із дисменореєю [5].
У клінічній практиці показано ефективність німесуліду на кількох моделях гострого болю, зокрема, при гострому болю у нижній частині спини. В одному з досліджень було підтверджено, що німесулід є більш ефективним та безпечним препаратом у загальнолікарській практиці при гострому болю у нижній частині спини при прийомі 100 мг двічі на добу протягом 10 днів у порівнянні з ібупрофеном, який застосовували по 600 мг тричі на добу протягом 10 днів [6].
У роботі L. Konstantinovic та співавт. вивчалася ефективність низько-енергетичної лазерної терапії при гострому болю в нижній частині спини, що супроводжується здавленням сідничного нерва – люмбоішалгією. Автори оцінювали цей метод фізіотерапевтичного впливу на 546 хворих (3 групи), які одночасно приймали німесулід дозою 200 мг на добу. У першій групі пацієнти отримували німесулід + справжню лазеротерапію, в другій – тільки німесулід, а в третій – комбінація поєднання цього препарату та плацебо. Згідно отриманим даним, у першій групі ефект був максимальним – тут рівень знеболювання достовірно перевершував результати, отримані у двох контрольних групах. Тим не менш цікаво відзначити той факт, що німесулід сам по собі (друга група) і в комбінації з плацебо лазера давав дуже суттєве полегшення не тільки «механічного» болю в спині, а й нейропатичного [7].
Доведено, що німесулід є ефективним до застосування в пародонтології в лікуванні гінгівіту, пародонтиту, до та після проведення хірургічних втручань, запальних процесів у тканинах пародонту тощо. Також німесулід показаний до застосування при хірургічних втручаннях у порожнині рота, а саме: профілактика інфекційно-запальних ускладнень після видалення зуба, профілактика посттравматичних запальних ускладнень лікування переломів нижньої щелепи з метою превенції посттравматичних ускладнень. Дана ефективність пояснюється тим, що німесулід взаємодіє з каскадом арахідонової кислоти, знижуючи синтез ПГ шляхом інгібування ЦОГ; це єдиний із НПЗП, котрий пригнічує 5-ЛОГ, зменшуючи синтез прозапальних лейкотрієнів, інгібує інтерлейкіни-1 і -6, колагеназу та стромелізин, які руйнують періодонтальну зв’язку зуба [8].
ФОКУС НА ВИСОКИЙ ПРОФІЛЬ БЕЗПЕКИ НІМЕСУЛІДУ
Фармакокінетичні та фармакодинамічні аспекти дії німесуліду мають велике значення у забезпеченні гастроентерологічної безпеки. Селективне пригнічення ЦОГ-2 відіграє в цьому головну роль, проте є дані щодо унікальних характеристик німесулід, що відрізняються від пригнічення ЦОГ [11].
Однією з характеристик, що пояснює ступінь безпеки німесуліду, є кислотність. Якщо кислотність препарату низька, то відбувається його накопичення у високій концентрації всередині клітин слизової та підслизової оболонок шлунку, де середовище і так відрізняється низькою рН, що викликає сильне подразнення слизової оболонки ШКТ [11].
Німесулід — єдиний представник похідних сульфананілідів, має відносно високий рівень кислотності — 6,5 (практично нейтральне) — і при хорошій абсорбції менше іонізується, завдяки чому він не утримується в слизовій оболонці і не захоплюється мітохондріями, а це означає меншу частоту розвитку — гастропатії при прийомі німесуліду.
Ще одним важливим нюансом фармакінетики німесуліду вважається досить короткий період напіввиведення. Він асоціюється з коротким часом інгібування ЦОГ-1 та забезпечує швидший ресинтез саме цієї форми ЦОГ, що сприяє більшій безпеці препарату. Саме завдяки цьому при використанні німесуліду, побічні ефекти виражені слабо.
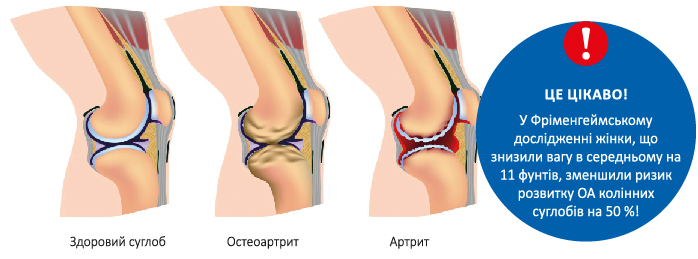
У рандомізованому подвійному сліпому клінічному дослідженні порівнювали ефективність та профіль безпеки німесуліду (100 мг 2 рази на добу) та диклофенаку (50 мг 1 раз на добу) в пацієнтів з остеоартрозом [9]. Тривалість дослідження становила 1 міс. Не відмічено статистично достовірної різниці ефективності німесуліду та диклофенаку, при цьому застосування німесуліду було пов’язане з меншою кількістю побічних ефектів з боку шлунково-кишкового тракту.
Також ефективність та профіль безпеки німесуліду (у дозі 200 мг на добу) у пацієнтів з остеоартрозом колінного суглоба вивчали порівняно з еталодалаком (600 мг на добу) [11]. Так, у подвійному сліпому рандомізованому мультицентровому клінічному дослідженні, в якому взяли участь 200 пацієнтів, було показано, що обидва препарати продемонстрували порівнянну ефективність та профіль безпеки протягом 3 місяців застосування.
Результати двох інших клінічних досліджень спричинили жваві дискусії. В одному з них — проспективному рандомізованому подвійному сліпому дослідженні за участю 30 пацієнтів порівнювали ефективність німесуліду (100 мг), целекоксибу (200 мг) та рофекоксибом (25 мг) при симптоматичній терапії при остеоартрозі колінного суглоба протягом 7 днів [12]. В іншому — проспективному рандомізованому подвійному сліпому дослідженні вивчена знеболювальна дія німесуліду (100 мг 2 рази на добу) у порівнянні з целекоксибом (200 мг) у 20 пацієнтів з остеоартрозом колінного суглоба з супутнім синовітом суглоба протягом 14 днів [13]. Результати даного дослідження показали, що німесулід має більш виражений ефект з більш раннім початком знеболювальної дії порівняно з целекоксибом. При цьому відмінності за профілем переносимості препаратів були статистично достовірними.
Висока ефективність та сприятливий профіль безпеки німесуліду продемонстровано більш ніж у 200 рандомізованих контрольованих дослідженнях, що включали понад 90 тис. пацієнтів. Порівняно як із традиційними НПЗП німесулід забезпечує як мінімум еквівалентну, а в ряді випадків — більш високу ефективність.
На фармацевтичному ринку України німесулід представлений під торгівельною назвою АФФИДА-ФОРТ-НІМЕСУЛІД® (TM SCHONEN) від компанії ДЕЛЬТА МЕДІКEЛ [14]. До складу АФФИДА-ФОРТ-НІМЕСУЛІД® входить 100 мг німесуліду у вигляді гранул для оральної суспензії. Перевагами саме АФФИДА-ФОРТ-НІМЕСУЛІД® є висока анальгетична та протизапальна активність у поєднанні з фінансовою доступністю.

Отже, препарат АФФИДА-ФОРТ-НІМЕСУЛІД® може бути рекомендований при:
- лікуванні гострого болю;
- симптоматичному лікуванні остеоартриту з больовим синдромом;
- первинній дисменореї.
Вміст пакета АФФИДА-ФОРТ-НІМЕСУЛІД® висипають у склянку, розчиняють водою і приймають перорально після їжі. Для того щоб мінімізувати можливі небажані побічні ефекти, потрібно застосовувати мінімально ефективну дозу протягом найкоротшого часу. Максимальна тривалість курсу лікування — 15 діб.
Дорослим АФФИДА-ФОРТ-НІМЕСУЛІД® призначається по 100 мг німесуліду (1 однодозовий пакет) двічі на добу після їжі.
Отже, лікарський засіб АФФИДА-ФОРТ-НІМЕСУЛІД® може бути рекомендований для симптоматичного лікування гострого та хронічного болю. Крім цього, він добре розчиняється та має приємний апельсиновий смак.
АФФИДА-ФОРТ-НІМЕСУЛІД® — знеболюючий та протизапальний засіб з доведеною ефективністю, високим рівнем безпеки та за доступною ціною!
ЛІТЕРАТУРА:
- Матюха ЛФ. Больовий синдром, його вплив на організм і підходи до ефективного знеболення у практиці сімейного лікаря. Академія – дистанційна освіта on-line.2015;4(108).
- Main CJ, Williams AC. Musculoskeletal pain. BMJ.2002;325(7363):534-537.
- Glombiewski JA, Holzapfel S, Riecke J, et al. Exposure and CBT for chronic back pain: an RCT on differential efficacy and optimal length of treatment. J Consult Clin Psychil.2018;86(6):533-545.
- Хиць АР. Менеджмент хронічного больового синдрому: погляд з точки зору лікаря-невролога. УМЧ.2021; 12(17). URL: https://www.umj.com.ua/article/223180/menedzhment-hronichnogo-bolovogo-sindromu-poglyad-z-tochki-zoru-likarya-nevrologa
- Marjoribanks J, Proctor ML, Farquhar C, Derks RS. Nonsteroidal anti-inflammatory drugs for dysmenorrhea. Cochrane Database Syst Rev, 2010, 20(1).
- Pohjolainen T, Jekunen A, Autio L, Vuorela H. Treatment of acute low back pain with the COX-2-selective anti-inflammatory drug nimesulide: results of a randomized, double-blind comparative trial versus ibuprofen. Spine (PhilaPa 1976) 2000; 25 (12): 1579–85.
- Konstantinovic L, Kahjun Z, Milovanovic A, et al. Acute low back pain with radiculopathy: a double-blind, randomized, placebo-controlled study. Photomed laser surg 2010; 28(4):555–60.
- Spencer C.J. The Examination, Differential Diagnosis, and Management of Toothache Pain. The Dental Reference Manual. 2016. 391-408.
- Porto A. et al. (1993) Double-blind study evaluating by endoscopy the tolerability of nimesulide and diclofenac on the gastric mucosa in osteoarthritic patients. Eur. J. Rheumatol. Inflam., 14(4): 33–38.
- Lücker P.W. et al. (1993) Double-blind, randomised, multi-centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee. Eur. J. Rheumatol. Inflam., 14(2): 29–38.
- Bianchi M., Broggini M. (2003) A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee. Drugs, 63(1): 37–46.
- Німесулід – найбільш ефективний із найбільш безпечних. Health-ua.com. С. 3–8.
- Bianchi M. et al. (2007) Effects of nimesulide on pain and on synovial fluid concentrations of substance P, interleukin‐6 and interleukin‐8 in patients with knee osteoarthritis: comparison with celecoxib. Intern. J. Clin. Practice, 6(8): 1270–1277.
- Інструкція Аффида Форт-німесулід: https://mozdocs.kiev.ua/likiview.php?id=30809
Марина Остапець, кандидат медичних наук, доцент

 21-дек-2024
21-дек-2024